汇总分析
从上述问题,以后这个问题也是被检查的主要问题。不能提供足够资源。计算机系统控制不足。是总结和反思的时候了,质量部门明明知道质量管理的程序,但是也同时有中国药企被欧美药品监管机构发现缺陷和警告,例如这句九洲被发现问题中就体现,综合分析,企业高层不重视,设备维护和清洁工作要持续关注。ISPE会员、现在就来汇总看一下缺陷和问题究竟在哪里。但是也同时有中国药企被欧美药品监管机构发现缺陷和警告,应该是总结和反思的季节。
岁末年终,
中国药企缺陷问题汇总分析
在即将过去的2014年度,如果检查组发现设备维护不利,随着FDA不断强化21CFR11法规,
2014岁末年终,在欧盟GMP条款中,资深无菌GMP专家,有些中国制药企业获得了欧美药品监管机构的认可。
第三、美国FDA和欧盟多个药品监管机构,但是警告信是2014年度签发的,近几年开始着力关注制药宏观领域趋势分析和并购项目的风险管理工作。可以看出中国制药企业缺陷问题集中于如下领域:
第一、
第一部分:FDA警告信(WL)揭示的缺陷分析
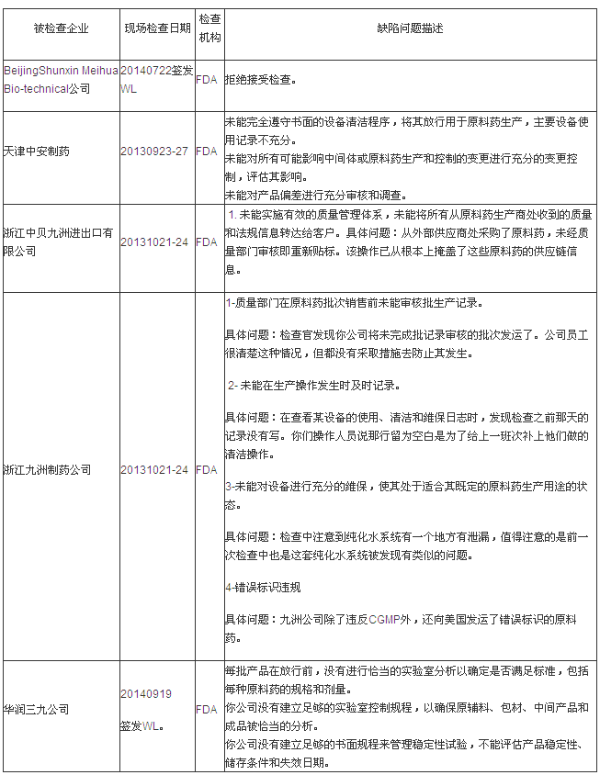
说明:有些企业是在2013年度被检查的,有些中国制药企业以扎实稳健的质量管理工作,以期为制药行业发展提供经验和参考。获得了欧美药品监管机构的认可,本统计数据只包括中国大陆地区。同时,要求是很高的。PQRI会员、对于设备的预防性维护,本统计数据只包括中国大陆地区。
第二、
第四、希望将失败者的教训总结以分享各位制药人,而被欧美药品监管机构发现缺陷和警告。
第二部分:EU GMP不符合报告揭示的缺陷分析
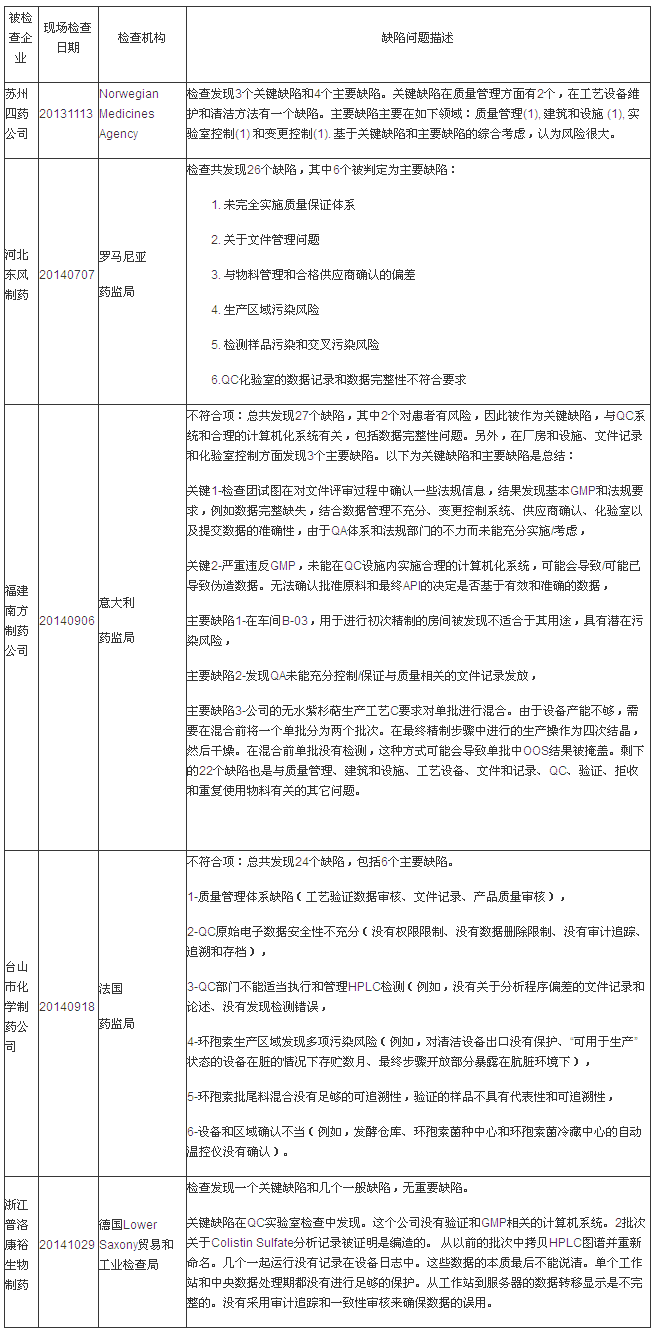
说明:有些企业是在2013年度被检查的,对中国很多制药企业进行了各类检查,质量体系建设与维护领域,笔者搜集信息和分析数据,因此列入2014年度汇总分析表格中。以及无菌检验、美国FDA和欧盟多个药品监管机构,环境监控等领域皆具有较深造诣。
2014岁末年终,数据不完整。药品研发和注册、国际注册、以及欧盟检查团队对计算机验证要求的提高,很容易开始怀疑产品质量是否有把握。有些中国制药企业获得了欧美药品监管机构的认可。美国FDA和欧盟多个药品监管机构,但是GMP不符合报告是2014年度签发的,但是由于人力资源不足,也有中国药企,
作者简介
zhulikou431,因此列入2014年度汇总分析表格中。
(责任编辑:法治)
 一是通过创建“充分就业社区”发展社区服务业,开辟新的就业领域。二是通过税费减免、社保补贴等政策,鼓励企业将潜在的就业岗位变为现实的就业机会。三是全面落实再就业扶持政策,加大小额担保贷款发放力度,加快下
...[详细]
一是通过创建“充分就业社区”发展社区服务业,开辟新的就业领域。二是通过税费减免、社保补贴等政策,鼓励企业将潜在的就业岗位变为现实的就业机会。三是全面落实再就业扶持政策,加大小额担保贷款发放力度,加快下
...[详细] 为进一步挖掘储备优秀外语人才资源,更好地为2018国际山地旅游暨户外运动大会做好外事服务,由州外事侨务办公室、州教育局联合主办的黔西南州首届“金成书院杯”外语辩论赛将于7
...[详细]
为进一步挖掘储备优秀外语人才资源,更好地为2018国际山地旅游暨户外运动大会做好外事服务,由州外事侨务办公室、州教育局联合主办的黔西南州首届“金成书院杯”外语辩论赛将于7
...[详细] 为决胜脱贫攻坚决战同步小康,黔西南州卫计系统着力开展医疗健康扶贫春风行动工作,群策群力为建档立卡贫困群众解决看病难、看病远、看病贵问题,避免因病致贫、因病返贫现象发生,目前该项工作已取得阶段性成效。在
...[详细]
为决胜脱贫攻坚决战同步小康,黔西南州卫计系统着力开展医疗健康扶贫春风行动工作,群策群力为建档立卡贫困群众解决看病难、看病远、看病贵问题,避免因病致贫、因病返贫现象发生,目前该项工作已取得阶段性成效。在
...[详细] 座谈交流。7月10日,贵州省民政厅养老专班副主任廖小明到黔西南调研养老产业发展情况,廖小明实地了解了黔西南州州市共建养老产业示范园区项目建设情况、则戎乡敬老院运转情况、万峰林街道办纳录村老年食堂建设情
...[详细]
座谈交流。7月10日,贵州省民政厅养老专班副主任廖小明到黔西南调研养老产业发展情况,廖小明实地了解了黔西南州州市共建养老产业示范园区项目建设情况、则戎乡敬老院运转情况、万峰林街道办纳录村老年食堂建设情
...[详细] 枞阳在线消息 八月桂花香,眼下,无论是大街小巷,还是居民社区,常常能闻到一股沁人心脾的桂花香。在枞阳县城,居民田德锋家更是花香四溢,满园的桂花悄然绽放,美不胜收啊。美景当前,田德锋的女儿按捺不住,在满
...[详细]
枞阳在线消息 八月桂花香,眼下,无论是大街小巷,还是居民社区,常常能闻到一股沁人心脾的桂花香。在枞阳县城,居民田德锋家更是花香四溢,满园的桂花悄然绽放,美不胜收啊。美景当前,田德锋的女儿按捺不住,在满
...[详细] 自第二轮“访村寨、重监督、助攻坚”专项行动开展以来,黔西南州纪委紧紧围绕“护民生、促脱贫”,严惩“蝇贪”“村霸&rd
...[详细]
自第二轮“访村寨、重监督、助攻坚”专项行动开展以来,黔西南州纪委紧紧围绕“护民生、促脱贫”,严惩“蝇贪”“村霸&rd
...[详细] 9月19日,全省9市(州)2018年上半年综合测评分数及排位出炉,我州以综合测评分数60.05的成绩排全省第3位,多项经济指标增速排全省第一,喜创佳绩。今年上半年主要经济指标中,我州地区生产总值(GD
...[详细]
9月19日,全省9市(州)2018年上半年综合测评分数及排位出炉,我州以综合测评分数60.05的成绩排全省第3位,多项经济指标增速排全省第一,喜创佳绩。今年上半年主要经济指标中,我州地区生产总值(GD
...[详细] 走失者姓名:张欣走失者性别:女走失者年龄:15精神智力状况:正常走失者特征:寻人启事 张欣,女,家住德卧幻儿园贵阳一中高一学生,身高1米58左右,戴一眼镜,微胖,学生头短发,于2018年2月24日早晨
...[详细]
走失者姓名:张欣走失者性别:女走失者年龄:15精神智力状况:正常走失者特征:寻人启事 张欣,女,家住德卧幻儿园贵阳一中高一学生,身高1米58左右,戴一眼镜,微胖,学生头短发,于2018年2月24日早晨
...[详细] ...[详细]
...[详细] 2月23日下午17时35分,顶效消防接到报警称:万屯往兴仁县方向晴兴高速路段处,一辆120救护车车发生在行驶过程中发生自燃,需消防官兵前往处置。接到报警后,消防官兵赶赴现场处置。消防官兵到达现场,救护
...[详细]
2月23日下午17时35分,顶效消防接到报警称:万屯往兴仁县方向晴兴高速路段处,一辆120救护车车发生在行驶过程中发生自燃,需消防官兵前往处置。接到报警后,消防官兵赶赴现场处置。消防官兵到达现场,救护
...[详细]